植物重组蛋白SOD(Rr-SOD)的还原型与氧化型催化机制
免疫诊断试剂国家工程实验室高级研究员 左有权
超氧化物歧化酶(SOD,9054-89-1)是一种含金属蛋白质的酶,它是含多种金属酶的蛋白家族,以多个常见形式存在:主要以铜和锌、或锰、铁、或镍作为辅因子。其理化性质不仅取决于酶蛋白,而且还由其分子结构及结合到活性部位的金属离子决定。是目前为止发现的唯一具有专一清除超氧阴离子自由基(O.-)2,防止氧自由基破坏细胞的组成、结构和功能,保护细胞免受氧化损伤,并能预防治疗由其引发的相关疾病的作用。

事实上,扬名全世界的SOD 之所以倍受关注和青睐,并不仅仅是因为它是美国科学家发现并研制成功的成果,也不仅仅是因为它是活细胞的成分,而是它能通过催化超氧阴离子自由基(·O2) 发生歧化反应,减轻或消除超氧阴离子自由基(·O2) 及其代谢产物或衍生物所诱导的氧化或过氧化反应对机体的损伤和危害。特别是SOD 作为体内唯一能够有效清除超氧阴离子自由基的特异性酶,其结构中的非蛋白质部分的辅助因子或辅基为金属离子、并以金属螯合物形式存在。
Cu,Zn-SOD的活性中心中,Cu被四个组氨酸残基的咪唑环上的N原子配位,另外一个水分子中的O在轴向与Cu配位构成一个畸变的N4O四方锥结构,而Zn被3个组氨酸咪唑环上的N原子和一个天冬氨酸中的一个羧基O原子配位形成一个近似N3O的四面体结构。其中一个组氨酸的咪唑起着桥的作用与铜锌共同相连 。铜锌离子相距0.63nm。
当铜离子被氧化时,它和四个组氨酸残基相协调并且通过一个组氨酸残基与锌相连,当Cu(Ⅱ)和O2-·反应时,一个电子从O2-·移动到Cu(Ⅱ),从而产生了Cu(Ⅰ)和O2,O2作为酶促反应的产物。在Cu,Zn-SOD的三角形平面可以通过铜离子大约0.1nm的移动得到,同时伴随着组氨酸的质子化(获得H)作用产生了细微的移动(铜锌共同相连的组氨酸),伴随着电子的传递过程使得能量梯度变小,Cu(Ⅰ)首先和三个组氨酸残基相连(三角形平面结构),再和铜锌共同相连的组氨酸形成比较松弛的键。
还原型的催化中心有着和氧化型的催化中心相同的带电区域,O2-·的扩散速率也是相同的。最初反应时,氧化型和还原型的酶有着相同的反应速率。当O2-·靠近还原型酶时,它和铜锌共同相连的组氨酸的N2的质子键合,一旦Cu(Ⅱ)形成,它和这个组氨酸结合。质子从这个组氨酸的N和O2-·之间传递,使得Cu(Ⅱ)和此组氨酸键的重新形成产生了障碍。当O2-·靠近Cu(Ⅰ)时,碰到了铜锌相连的组氨酸的质子而发生电子传递,水分子中释放出一个质子,同时生成Cu(Ⅱ)和HO2-· ,H2O2释放而不再与Cu(Ⅱ)结合。
活性部位的Cu与O2-·反应如下:
E-Cu2+ + O2-· → E-Cu+ + O2
E-Cu+ + O2-·+ H+ → E-Cu2+ + HO2-·
HO2-·+ H+ → H2O2
(E为Cu,Zn - SOD中的一个亚基)
O2-·将水分子代替而与铜离子配位而发生第一步反应;第二步反应中需要质子的参与。质子很可能来自精氨酸残基,锌离子起着稳定酶蛋白结构的作用,因此它间接有助于O2-·的催化。
与铜、锌相连的“咪唑桥”在Cu,Zn-SOD催化反应中起着重要的作用。铜锌超氧化物歧化酶的活性需要两种金属的协同作用,在每一轮催化循环中,连接铜离子和锌离子的咪唑桥先被断开而后又重新形成。在桥断裂后,铜离子发生氧化还原作用,催化超氧负离子歧化反应。
反应如下(Im为咪唑基)
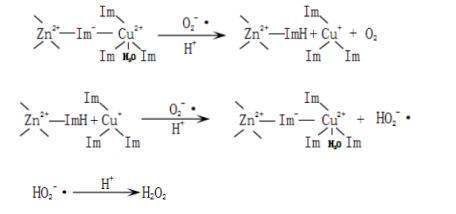
在Cu,Zn-SOD的催化反应中,两个亚基虽然独立催化O2-·歧化,但它们的相互作用也是不可忽视的。一个亚基的失活可诱导另一个亚基的失活,从而导致两个亚基都失活。
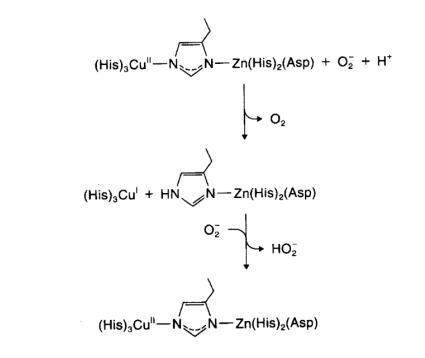
(上图)铜锌超氧化物歧化酶可能的桥断裂机制
正是SOD 这种特殊的结构,使它对由于超氧阴离子自由基诱导的衰老、炎症、肿瘤、辐射病、自身免疫性疾病、心脑缺血再灌注综合症、白内障、治疗全身性红斑狼疮、类风湿性关节炎、皮肌炎、硬皮病、自身免疫性溶血性贫血、血小板减少症等自身免疫性疾病;心肌缺血与缺血再灌注综合征等相关疾病具有良好的防治效果,以及SOD 对某些亚健康状况、癌症化疗和放疗、消化系统疾病( 慢性胃炎、萎缩性胃炎等)、呼吸系统疾病( 哮喘、支气管炎等)、皮肤病( 接触性皮炎、日光性皮炎、黄褐斑等)、烧伤及修复等都均有一定辅助疗效。
